Anaemia has been acknowledged as a frequent systemic complication and/or extraintestinal manifestation in inflammatory bowel disease (IBD)1 with iron deficiency (ID) being the primary cause of disease2 with an estimated prevalence of iron deficiency anaemia (IDA) among patients with IBD at approximately 45 %.3
Considering the potential effect on hospitalization rates and consequences for patients quality of life, anaemia has been described as a significant and costly complication of IBD.4 However, ID and IDA are under-treated.5
The pathogenesis of ID in IBD is complex, comprising intestinal bleeding, malabsorption, and inadequate oral intake.3 As symptoms of IDA mimic the symptoms of the disease such as fatigue,6 regular screening and diagnosis in these patients are crucial to uncover ID and IDA and therapy of anemia may even improve the quality of life better than the therapy of disease activity.5
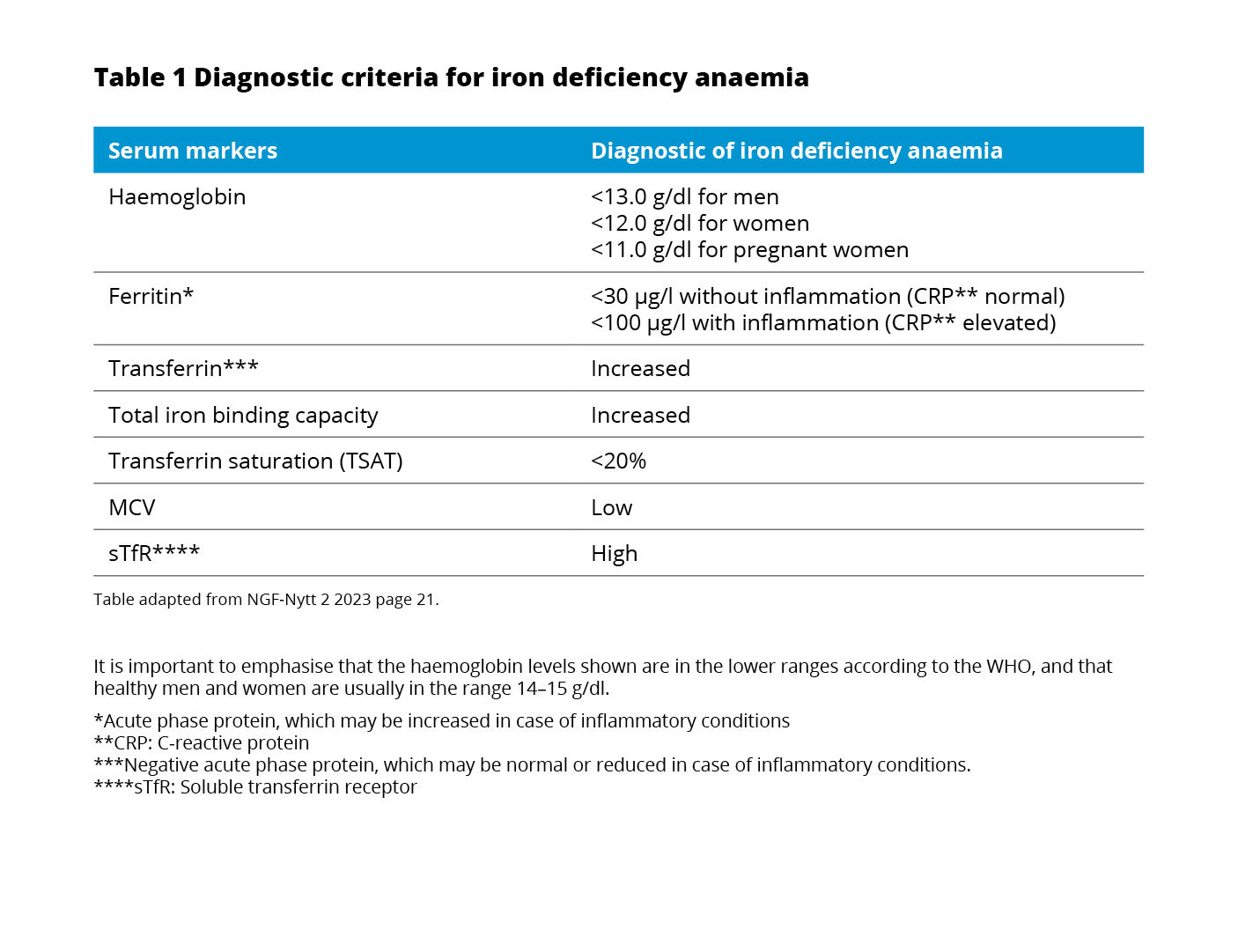
The currently used WHO definition of anaemia7 also applies to patients with IBD.8 All patients with IBD should be assessed for the presence of anaemia through laboratory testing of blood count, serum ferritin, and C-reactive protein every 6-12 months.8
If the hemoglobin (Hb) is below normal, anaemia workup should be initiated including red blood cell distribution width (RDW) and mean corpuscular volume (MCV), reticulocyte count, differential blood cell count, serum ferritin, transferrin saturation (TSAT), and CRP concentration.8
Even when IBD patients are screened, ID and IDA might be overlooked as commonly used laboratory tests may be compromised due to several pathophysiological mechanisms related to the inflammatory nature of IBD9
Consequently, when evaluating ID and IDA in IBD the following mechanisms should be taken into consideration:
Hemoglobin: Iron deficiency should not be excluded despite normal Hb as Hb levels do not decline until a significant amount of iron is lost.10
Ferritin: Besides binding and storing iron in the liver, spleen, and reticuloendothelial system ferritin is also an acute-phase protein and can be increased in the presence of inflammation.11 Following, the interpretation of serum ferritin in patients with inflammation is tricky.5
Hepcidin and ferroportin: The hepatic peptide hormone hepcidin functions as an important regulator of iron homeostasis by controlling ferroportin – the sole iron exporter. However, hepcidin also increases as a response to inflammation.13 The increased levels of hepcidin caused by inflammation will promote the degradation of ferroportin and subsequently impair the exportation of cellular iron into plasma.13
Transferrin saturation: The main iron carrier protein is transferrin.6 In the presence of inflammation, a normal ferritin level does not exclude ID.14 In this case, testing TSAT provides an indication of the extent of iron utilization.10
Soluble transferrin saturation receptor: The TSAT level only indicates the extent of iron utilization.4 A more extensive workup should include soluble transferrin receptor (sTfR) testing.8 sTfR is a truncated form of the cellular transferrin receptor and circulates bound to transferrin.10 It is released in proportion to the expansion of erythropoiesis in the bone marrow and is not regulated by inflammation.5 As a reflector of erythropoiesis, sTfR correlates with the amount of iron available.
Iron supplementation is recommended by The European Chron’s and Colitis Organisation (ECCO) in all IBD patients with IDA with the goal of normalizing hemoglobin levels and iron stores.8
While oral iron substitution is safe, affordable, and easy to administer it might not be the perfect solution for patients with IBD:3
Hence, IV iron therapy is considered first-line treatment for patients with active disease, severe anemia, oral iron intolerance, and erythropoietin requirements.3,8
ATC: B03AC. Trevärt järn, parenteralt preparat. Injektions-/infusionsvätska 100 mg/ml. Injektionsflaska i förpackningsstorlekar: 1x5 ml, 1x10 ml, 5x1 ml, 5x5 ml och 2x10 ml.
För fullständig information och priser, se www.fass.se.
Indikation: Monofer är indicerat för behandling av järnbrist vid följande tillstånd: När perorala järnpreparat är ineffektiva eller inte kan användas. Vid kliniskt behov av snabb tillförsel av järn. Diagnosen järnbrist måste baseras på tillämpliga laboratorieprover. Kontraindikationer: Anemi som inte orsakas av järnbrist. Järnöverbelastning eller rubbning i kroppens användning av järn. Överkänslighet mot den aktiva substansen Monofer eller mot något hjälpämne. Konstaterad allvarlig överkänslighet mot andra parenterala järnprodukter. Dekompenserad leversjukdom. Särskilda varningar och försiktighetsmått: Parenteralt administrerade järnpreparat kan ge upphov till överkänslighetsreaktioner inklusive allvarliga och potentiellt dödliga anafylaktiska/anafylaktoida reaktioner. Överkänslighetsreaktioner har även rapporterats när tidigare doser av parenterala järnkomplex inte har resulterat i några oönskade effekter. Det har förekommit rapporter om överkänslighetsreaktioner som har utvecklats till Kounis syndrom. Risken är större för patienter med konstaterade allergier inklusive läkemedelsallergier, däribland patienter med svår astma, eksem eller andra atopiska allergier i anamnesen. Det finns även en ökad risk för överkänslighetsreaktioner mot parenterala järnkomplex hos patienter med immunologiska eller inflammatoriska tillstånd. Monofer ska endast administreras när personal som är utbildad i att bedöma och hantera anafylaktiska reaktioner finns tillhands, i en miljö där lokaler och utrustning för återupplivning garanterat finns tillgängliga. Varje patient ska observeras avseende biverkningar under minst 30 minuter efter varje injektion av Monofer. Om överkänslighetsreaktioner eller tecken på intolerans uppkommer under administrering måste behandlingen stoppas omedelbart. Lokaler för hjärt-lungräddning och utrustning för hantering av akuta anafylaktiska/anafylaktoida reaktioner ska finnas tillgängliga, inklusive en injicerbar 1:1 000 adrenalinlösning. Ytterligare behandling med antihistaminer och/eller kortikosteroider ges efter behov. Hos patienter med kompenserad leverdysfunktion ska parenteralt järn endast administreras efter noggrann nytta/riskbedömning. Administrering av parenteralt järn ska undvikas hos patienter med leverdysfunktion där järnöverskott är en förvärrande faktor, särskilt vid porfyria cutanea tarda (PCT). Noggrann övervakning av järnstatus rekommenderas för att undvika järnöverskott. Parenteralt järn bör användas med försiktighet vid fall av akut eller kronisk infektion. Monofer bör inte användas för patienter med pågående bakteriemi. Hypotensiva reaktioner kan uppträda om den intravenösa injektionen ges för snabbt. Försiktighet bör vidtas för att undvika paravenöst läckage vid administrering av Monofer. Paravenöst läckage av Monofer kan leda till hudirritation och eventuellt långvarig brun missfärgning vid injektionsstället. Vid paravenöst läckage måste administreringen av Monofer stoppas omedelbart. Graviditet: Det finns endast begränsade data från användning av Monofer hos gravida kvinnor. En noggrann nytta/risk-bedömning krävs därför före användning under graviditet. Fosterbradykardi kan förekomma efter administrering av parenteralt järn. Tillståndet är vanligtvis övergående och är en följd av en överkänslighetsreaktion hos modern. Amning: Vid terapeutiska doser av Monofer förväntas inga effekter hos det ammade barnet. Produktresumé uppdaterad 2022-08-11
Pharmacosmos A/S, Roervangsvej 30, DK-4300 Holbaek, Danmark.
07-SCAN-11-09-2023.v1
PHOSPHARE-IBD study presentation
Gastro advertorial Sweden
Cardio advertorial Sweden
Gastroenterology article 2