
Svært mange pasienter med inflammatorisk tarmsykdom har jernmangel eller jernmangelanemi. – En utilstrekkelig anerkjent tematikk, mener professor ved Lunds universitet.
Jernmangel og jernmangelanemi er den vanligste systemiske komplikasjonen av IBD. Mellom 20 og 40 prosent av alle pasienter med inflammatorisk tarmsykdom har jernmangelanemi, mens jernmangel er til stede hos 35–75 prosent1. Dette er en utilstrekkelig anerkjent tematikk ifølge Stefan Lindgren, professor emeritus ved Lunds universitet og tidligere overlege i gastroenterologi ved Skånes universitetssykehus.
–Det er viktig å se på helheten når man behandler pasienter med langvarige sykdomstilstander. For pasienter med inflammatorisk tarmsykdom (IBD) er det å bli betennelsesfri det fremste behandlingsmålet, men det er ikke det eneste som er viktig eller avgjørende for hvordan de har det og om hvorvidt kan leve livene sine i til sitt fulle potensial, sier Stefan Lindgren.
– Pasientrapporterte studier viser at det er viktig å få god omsorg, føle trygghet, være godt informert og involvert i sin egen omsorg og behandling, og å ikke lide av unødvendig tretthet (fatigue) eller ekstraintestinale komplikasjoner. Mest mulig velvære, rett og slett, og da er normal jernstatus en viktig ting å oppnå.
Han understreker viktigheten av at helsevesenet interesserer seg for jernmangel og jernmangelanemi når de behandler pasienter med IBD. Internasjonale retningslinjer sier at pasienter i betennelsesfri fase bør få jernstatusen kontrollert en gang i halvåret, mens de som har aktiv sykdom bør kontrolleres hver tredje måned.

Stefan Lindgren, professor emeritus ved Lunds universitet
– Jernmangelen er i seg selv svært viktig, fordi den har flere konsekvenser og kan til og med påvirke kognitive evner. Anemi og jernmangel reduserer generelt livskvaliteten og kompliserer på mange måter sykdomsforløpet ved IBD, sier Stefan Lindgren.
Intravenøs tilførsel av jern har lenge vært førstevalget ved behandling av jernmangel hos IBD-pasienter. De preparatene som er tilgjengelige, er effektive og trygge. Nyere studier viser imidlertid at jernkarboksymaltose ofte fører til hypofosfatemi, noe som motvirker forbedringen i tretthet som normaliseringen av jernstatus medfører. Hypofosfatemi kan på lengre sikt også forårsake skjelettkomplikasjoner og muskelsvakhet.
I en ny studie, PHOSPHARE-IBD2, ble forekomsten av hypofosfatemi etter behandling av jernmangelanemi hos pasienter med IBD sammenlignet med to forskjellige medisiner: jernkarboksymaltose, FCM (Ferinject) og jernderisomaltose, FDI (Monofer). Dette er den første dobbeltblindede randomiserte studien der begge medikamenter ble gitt i samme doser.
Totalt deltok 97 pasienter, hvor halvparten av pasientene fikk FCM og halvparten fikk FDI. Selv om både FCM og FDI behandlet jernmangelanemi like effektivt, viste studien at FCM var forbundet med en betydelig høyere forekomst av hypofosfatemi (51,0 %) sammenlignet med FDI (8,3 %).
Ønsker du mer informasjon om PHOSPHARE-IBD studiet, klikk her: Study Presentation | PHARMACOSMOS
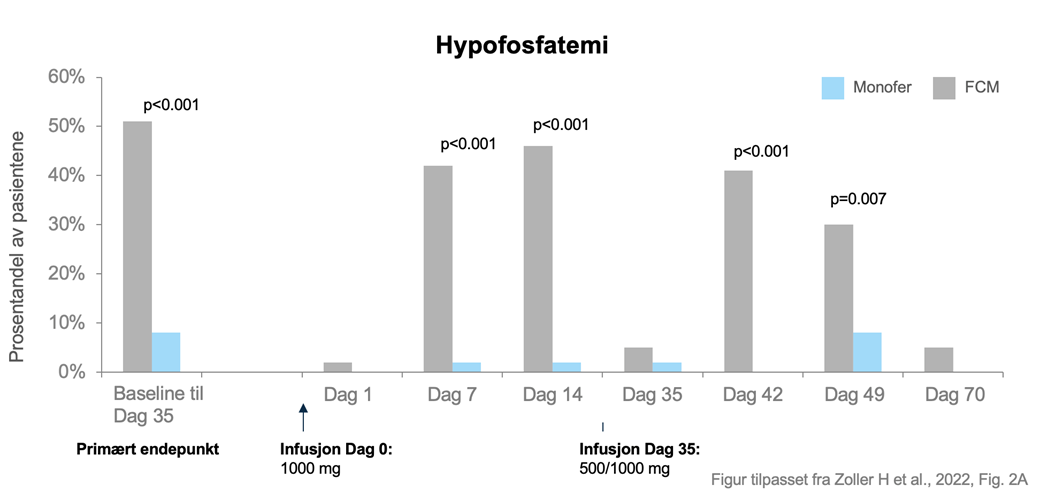
Alle (utenom to) pasienter fikk den første infusjonen av 1000 mg FDI eller FCM dag 0. Det primære endepunktet – insidensen av hypofosfatemi (definert som S-fosfat <2,0 mg/dL) ved noe tidspunkt etter den første dosen frem til dag 35 – var 8,3 prosent (n=4/48) i FDI-gruppen og 51 prosent (n=25/49) i FCM-gruppen.
– Denne studien bekrefter at jernmangel og jernmangelanemi er vanlig hos IBD-pasienter. Den bekrefter også at begge legemidlene behandlet jernmangelanemi effektivt og at trettheten ble forbedret, men saktere og i mindre grad med FCM sammenlignet med FDI. Den dårligere effekten på tretthet var knyttet til graden av fosfatmangel, sier Stefan Lindgren.
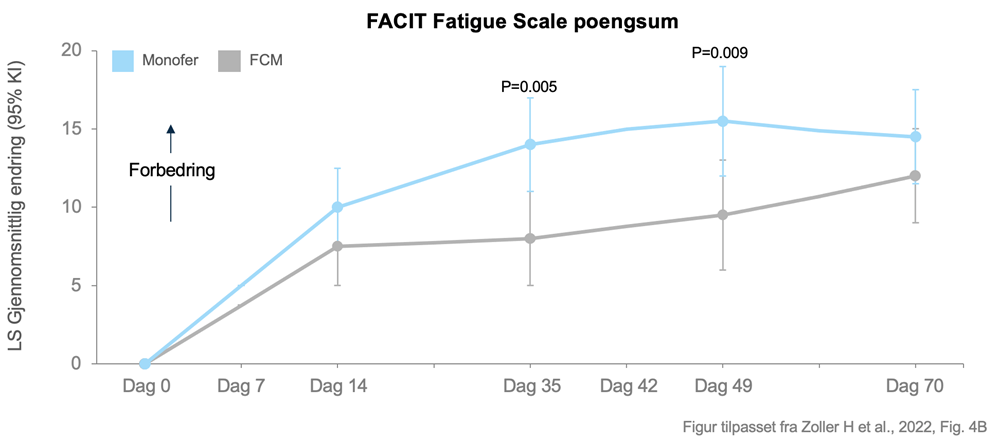
Begge medikamentene førte til forbedring av tretthetssymptomer (målt ved FACIT fatigue scale-scorer). Forbedringen i FACIT-score over tid var betydelig større for FDI sammenlignet med FCM ved dag 35 og dag 49. Lindgren understreker viktigheten av å opprettholde god livskvalitet hos pasienter med inflammatorisk tarmsykdom.
– Det er selvfølgelig fordelaktig å bruke et preparat som effektivt normaliserer jernstatus uten å forårsake andre biokjemiske effekter som forverrer pasientens livskvalitet og på sikt kan medføre andre komplikasjoner. Fatigue-skår, som ble brukt i PHOSPHARE-IBD-studien, er et klinisk relevant mål på de negative konsekvensene hypofosfatemi har på livskvaliteten.
– Dette bør bli tatt hensyn til, blant annet gjennom overvåkning av serum-fosfat ved gjentatt behandling med intravenøst jern, sier Stefan Lindgren.
Skal ikke brukes ved: kjent overfølsomhet, anemi uten at det foreligger jernmangel, for høyt jernnivå eller forstyrrelser i kroppens utnyttelse av jern, dekompensert leversykdom.
Brukes med forsiktighet ved akutt eller kronisk infeksjon. Bør ikke gis til pasienter med aktiv bakteriemi. Gis kun etter en grundig nytte-/risikovurdering ved nedsatt leverfunksjon.
Det er begrenset data på bruk av Monofer hos gravide kvinner. En grundig nytte/risiko-vurdering er påkrevd før bruk under graviditet. Behandling med Monofer bør begrenses til andre og tredje trimester. Føtal bradykardi kan oppstå etter administrering. Fosteret skal overvåkes nøye under i.v. administrering hos gravide.
Vanlige bivirkninger: Kvalme, utslett, reaksjoner på injeksjonsstedet.
Pasienten skal overvåkes nøye for tegn og symptomer på overfølsomhetsreaksjoner under og i minst 30 minutter etter hver administrering av Monofer.
Infusjons-/injeksjonsvæske, oppløsning 100 mg/ml. Indikasjoner: Behandling av jernmangel ved følgende indikasjoner: Ved klinisk behov for hurtig tilførsel av jern. Når orale jernpreparater ikke kan benyttes pga. manglende effekt eller ikke kan brukes av andre årsaker. Diagnosen må baseres på laboratorieprøver. Dosering: Doseringen gjøres trinnvis: [1] bestemmelse av det individuelle jernbehovet, og [2] utregning og administrasjon av jerndosen(e). Trinnene kan gjentas etter [3] vurdering av jernoppfylling etter jerntilskudd. Jernbehovet er uttrykt i mg elementært jern. Jernbehovet kan bestemmes enten ved en forenklet tabell basert på Hb-verdi og kroppsvekt eller ved Ganzoni-formelen (se preparatomtalen). For å vurdere effekten av Monofer skal Hb-nivået revurderes tidligst 4 uker etter siste administrering. Ved ytterligere behov for jern, må dette utregnes på nytt.
Ytterligere sikkerhetsinformasjon: Bør ikke brukes til barn og ungdom <18 år. Kan gi overfølsomhetsreaksjoner, inkl. alvorlige og potensielt dødelige anafylaktiske/anafylaktoide reaksjoner. De opptrer vanligvis i løpet av de første minuttene etter infusjonsoppstart og er karakterisert ved plutselig innsettende pustebesvær og/eller sirkulasjonssvikt. Overfølsomhetsreaksjoner som har utviklet seg til Kounis syndrom er sett. Risikoen er økt ved kjente allergier og ved autoimmune eller inflammatoriske tilstander. Behandlingen må stoppes umiddelbart ved overfølsomhetsreaksjoner eller tegn på intoleranse under administrering.
Pakninger og priser: Hetteglass: 5x1 ml kr 1532,40. 5x5 ml kr 7203,10. 2x10 ml kr 5770,60.
Reseptgruppe C
Basert på SPC godkjent 11.08.2022
For ytterligere informasjon om Monofer, se SPC.
05-SCAN-29-06-2023.v1
Note: Vennligst se den fullstendige preperatomtalen før produktet forskrives.
Legemiddelform: Infusjons-/injeksjonsvæske, jern(III)derisomaltose, oppløsning 100 mg/ml. Tilgjengelig som hetteglass: 5 x 1 ml, 5 x 5 ml og 2 x 10 ml. Indikasjoner: Behandling av jernmangel ved følgende indikasjoner: Ved klinisk behov for hurtig tilførsel av jern. Når orale jernpreparater ikke kan benyttes pga. manglende effekt eller ikke kan brukes av andre årsaker. Diagnosen må baseres på laboratorieprøver. Dosering: Doseringen gjøres trinnvis: [1] bestemmelse av det individuelle jernbehovet, og [2] utregning og administrasjon av jerndosen(e). Trinnene kan gjentas etter [3] vurdering av jernoppfylling etter jerntilskudd. Jernbehovet er uttrykt i mg elementært jern. Jernbehovet kan bestemmes enten ved en forenklet tabell basert på Hb-verdi og kroppsvekt eller ved Ganzoni-formelen (se preparatomtalen). For å vurdere effekten av Monofer skal Hb-nivået revurderes tidligst 4 uker etter siste administrering. Ved ytterligere behov for jern, må dette utregnes på nytt. Administrasjon: Preparatet gis som i.v. bolusinjeksjon, som i.v. infusjon eller som en injeksjon direkte i veneslangen ved hemodialyse. I.v. bolusinjeksjon: Doser opptil 500 mg pr. injeksjon opptil 3 ganger ukentlig og med injeksjonshastighet på opptil 250 mg jern/minutt kan tilføres. Dosen kan gis ufortynnet eller fortynnes. I.v. infusjon: Hele jerndosen, opptil 20 mg jern/kg kroppsvekt, kan gis som én engangsinfusjon eller som ukentlige infusjoner til det kumulative jernbehovet er gitt. Dersom jernbehovet overstiger 20 mg jern/kg kroppsvekt, må dosen deles opp i 2 administreringer med minst 1 ukes mellomrom. Det anbefales, når det er mulig, å gi 20 mg jern/kg i 1. administrering. Avhengig av klinisk skjønn kan 2. administrering avvente oppfølgende laboratorieprøver. Skal infunderes ufortynnet eller fortynnet, med steril 9mg/ml natriumkloridoppløsning, i maksimalt 500 ml. Kontraindikasjoner: Overfølsomhet for innholdsstoffene eller kjent overfølsomhet for andre parenterale jernpreparater. Anemi uten at det foreligger jernmangel (f.eks. hemolytisk anemi). For høyt jernnivå eller forstyrrelser i kroppens utnyttelse av jern (f.eks. hemokromatose, hemosiderose). Dekompensert leversykdom. Forsiktighetsregler: Parenteralt administrerte jernpreparater kan gi overfølsomhetsreaksjoner, inkl. alvorlige og potensielt dødelige anafylaktiske/anafylaktoide reaksjoner. Overfølsomhetsreaksjoner er også sett etter tidligere bivirkningsfrie doser av parenterale jernkomplekser. Overfølsomhetsreaksjoner som har utviklet seg til Kounis syndrom er sett. Risikoen er økt ved kjente allergier. Pasienten bør observeres for bivirkninger i minst 30 minutter etter hver administrasjon. Behandlingen må stoppes umiddelbart ved overfølsomhetsreaksjoner eller tegn på intoleranse under administrering. Parenteralt jern bør brukes med forsiktighet til pasienter med akutt eller kronisk infeksjon. Bør ikke gis til pasienter med aktiv bakteriemi. Overfølsomhets-reaksjoner kan oppstå, hvis IV injeksjonen gis for hurtig. Bivirkninger: Akutte, alvorlige overfølsomhetsreaksjoner kan forekomme ved administrering av parenterale jernpreparater. De opptrer vanligvis i løpet av de første minuttene etter infusjonsoppstart og er karakterisert ved plutselig innsettende pustebesvær og/eller sirkulatorisk kollaps. Vanlige: Kvalme, utslett, reaksjoner på injeksjonsstedet. Vennligst se den komplette preperatomtale for opplysninger om alle bivirkninger. Graviditet: Det er begrenset data på bruk av Monofer hos gravide kvinner, dette fra en studie med 100 behandlede gravide kvinner. En grundig nytte/risiko-vurdering er påkrevd før bruk under graviditet. Behandling med Monofer bør begrenses til andre og tredje trimester.
Ytterligere sikkerhetsinformasjon: Bør ikke brukes til barn og ungdom <18 år. Kan gi overfølsomhetsreaksjoner, inkl. alvorlige og potensielt dødelige anafylaktiske/anafylaktoide reaksjoner. De opptrer vanligvis i løpet av de første minuttene etter infusjonsoppstart og er karakterisert ved plutselig innsettende pustebesvær og/eller sirkulasjonssvikt. Overfølsomhetsreaksjoner som har utviklet seg til Kounis syndrom er sett. Risikoen er økt ved kjente allergier og ved autoimmune eller inflammatoriske tilstander. Behandlingen må stoppes umiddelbart ved overfølsomhetsreaksjoner eller tegn på intoleranse under administrering.
Pakninger og priser (per 09/22): ATC: B03AC. Hetteglass: 5 x 1 ml kr 1532,40. 5 x 5 ml kr 7203,10. 2 x 10 ml kr 5770,60.
Reseptgruppe C
Basert på SPC godkjent 11.08.2022.
For ytterligere informasjon om Monofer®, se SPC. www.felleskatalogen.no
Innehaver av markedsføringstilatelsen: Pharmacosmos A/S, Rørvangvej 30, DK- 4300 Holbæk, Danmark www.pharmacosmos.com.
PHOSPHARE-IBD study presentation
Cardio advertorial Norway
Gastroenterology article 1
Gastroenterology article 2